“I dati attuali evidenziano la presenza del biofilm nel 60%–100% delle ferite che non guariscono. Se da un lato il ruolo svolto dal biofilm nella cronicità delle ferite è ancora in fase di studio, risulta sempre più lampante che le ferite di difficile guarigione contengono biofilm, la cui presenza, in qualche modo, ne ritarda o impedisce la guarigione.
La gestione del biofilm nelle ferite croniche si sta rapidamente trasformando nell’obiettivo principale della cura delle ferite. Tuttavia, la gestione del biofilm è un’attività di innegabile complessità. Oltre ai passaggi basilari della prevenzione iniziale (l’impiego di agenti di contrasto del biofilm), della rimozione (dei residui e del tessuto necrotico) e della prevenzione di nuove formazioni (impiego di agenti antimicrobici), è necessario prendere in considerazione una miriade di altri parametri ambientali, clinici e relativi al paziente, per individuare una soluzione adatta al caso.” (World Union of Wound Healing Societies – WUWHS -, Congresso di Firenze, Documento di posizionamento. Gestione del biofilm. Wounds International 2016)
Lesioni cutanee a contatto con batteri patogeni
L’essere umano normalmente viene a contatto con diversi microrganismi che permangono nei vari distretti corporei senza arrecare danno, permettendo l’omeostasi e favorendo la buona funzione d’organo (es. la flora batterica intestinale o quella residente a livello cutaneo). Per contro è importante sottolineare come alcuni batteri diventino molto pericolosi se entrano in contatto con una persona con più patologie e soprattutto portatrice di lesione cutanea cronica.
In una lesione cutanea in fase di contrazione (durante la seconda settimana del processo di guarigione, i fibroblasti assumono l’aspetto di miofibroblasti (…). La comparsa dei miofibroblasti corrisponde all’inizio del compattamento del tessuto connettivo e alla contrazione della ferita) la normale flora batterica risulta fluttuante, separata e facilmente eliminabile attraverso la detersione con soluzione fisiologica e applicazione di una medicazione consona al letto di ferita.
Leggi anche: La valutazione e il trattamento delle ulcere vascolari dell’arto inferiore
La formazione del biofilm batterico sulla ferita cronica
Quando i batteri si ancorano al fondo della lesione, diventando comunità aggregate di cellule a crescita lenta, possono iniziare a comunicare tra loro e dare vita al biofilm provocando una colonizzazione critica.
Il biofilm batterico, definito come un’aggregazione stabile e complessa di microrganismi che interagiscono chimicamente tra loro promuovendo la secrezione di una matrice polisaccaridica adesiva e protettiva, si costituisce in 5 fasi:
- 1 fase: attecchimento iniziale
- 2 fase: attecchimento irreversibile
- 3 e 4 fase: maturazione
- 5 fase: dispersione per colonizzare altre zone
La formazione del biofilm batterico
Quando il biofilm si è formato, all’interno di una lesione cutanea si assiste a:
- aumento delle colonie batteriche
- migrazione programmata delle colonie affinché vengano “conquistati” i tessuti circostanti e quelli più profondi
- tendenza all’ infiammazione cronica e alla riduzione della tensione di ossigeno localizzato all’interno della ferita
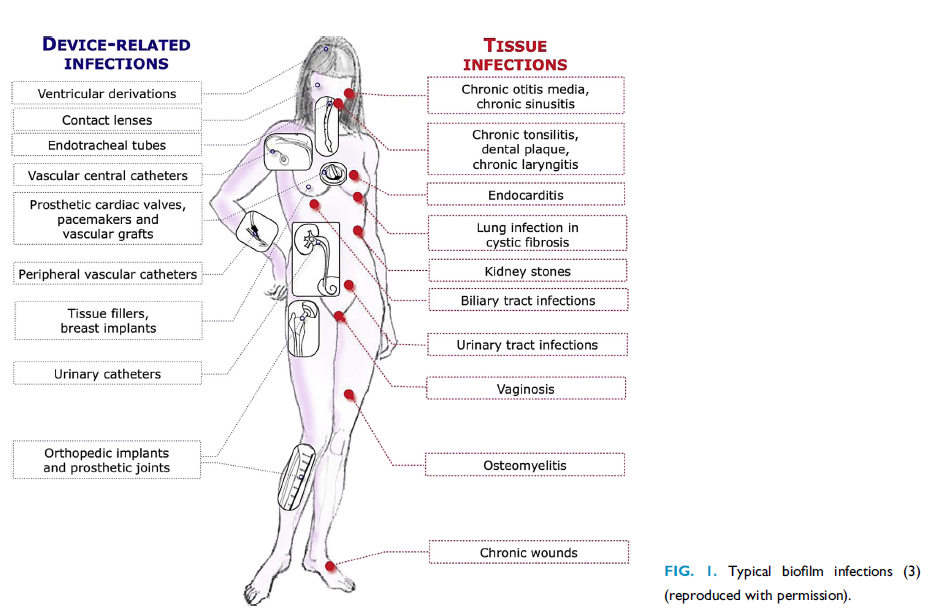
L’immagine di seguito illustra le principali localizzazioni corporee del biofilm batterico sia a livello di tessuti che di dispositivi medici (Linee Guida ESCMID 2015) .
E’ importante sapere che il biofilm:
- protegge i batteri dai più usuali disinfettanti e antimicrobici locali
- può persistere nonostante una terapia antibiotica sistemica (generalmente le colonie eterogenee sono più resistenti e stabili rispetto a quelle monospecie)
- è impenetrabile alle cellule immunitarie come ad esempio ai fagociti: il biofilm batterico prodotto da colonie di Pseudomonas Aeruginosa ha mostrato che i fagociti sono paralizzati o uccisi da un fattore secreto dal batterio stesso e denominato Rhamnolipide, la lisi dei fagociti provoca ulteriore infiammazione che attira altri PMN che verranno a loro volta neutralizzati determinando così uno stallo alla guarigione.
Cura e assistenza al paziente con ferite acute e ulcere croniche
Quali sono le medicazioni adeguate per un’ulcera da pressione in un neonato” Le vesciche vanno rimosse” Come trattare un’ustione superficiale” Quali sono i segni secondari di infezione” Cosa fare in caso di un’ulcera maleodorante” e in caso di dermatite da incontinenza” Come prevenire le ulcere da pressione del tallone” Quali sono i problemi della ricerca infermieristica nel campo del wound care” Quali sono le caratteristiche cliniche da rilevare” Come si prepara un intervento educativo per un paziente con ulcere” Pensato e scritto da infermieri con una preparazione specifica nei diversi ambiti della cura delle lesioni, questo libro affronta temi particolari e poco conosciuti, ma ben presenti nella pratica quotidiana. Il manuale coniuga le più recenti prove di efficacia – mettendone in luce gli elementi critici e i punti di forza – con l’esperienza degli autori. Il modo in cui sono trattati i singoli argomenti non offre al lettore “ricette facili” (spesso fallimentari), ma fornisce percorsi per trovare soluzioni differenti a pazienti unici. Caula Claudia, infermiera, esperta in wound care, referente ulcere da pressione RSA Vignola (MO). Alberto Apostoli, infermiere, podologo, esperto in wound care. Master in Assistenza Infermieristica in Area Geriatrica. U.O. Chirurgia Plastica, Azienda Spedali Civili (Brescia).
Claudia Caula, Alberto Apostoli | 2010 Maggioli Editore
42.00 € 39.90 €
Come prevenire la formazione del biofilm batterico
Una corretta strategia terapeutica deve essere multidisciplinare e soprattutto prevenire la situazione di colonizzazione critica dove solitamente avviene l’insediamento del patogeno sul fondo della ferita con la successiva produzione di matrice polisaccaridica trasformando così una lesione sanabile in una non sanabile.
Il rilevamento precoce del biofilm batterico, fondamentale per la prevenzione, è di difficile attuazione, ed è sempre aperto il dibattito se sia possibile o meno vederlo a occhio nudo.
Nella pratica clinica è possibile fare riferimento alle Linee Guida ESCMID 2015 che riportano i seguenti elementi come indicatori di sospetto biofilm:
- lesione stazionaria
- incompleta risposta agli antibiotici per via sistemica
- segni di infezione di durata superiore ai 30 giorni
- tessuto di granulazione friabile
- materiale gelatinoso facilmente rimosso dalla superficie della ferita che si rigenera rapidamente.
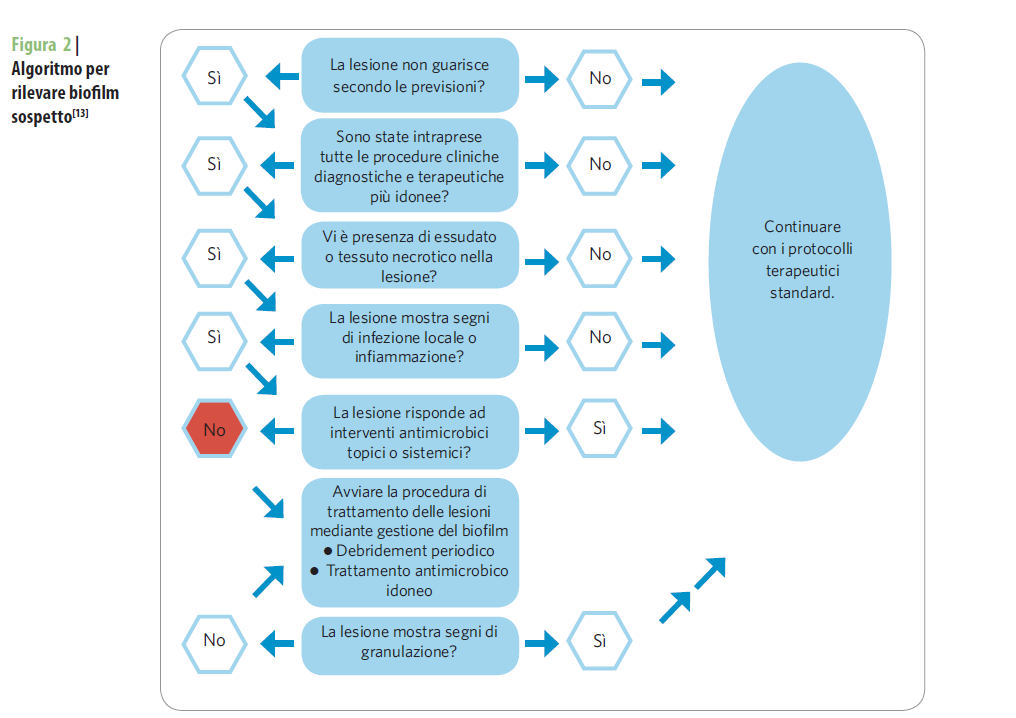
“Una volta stabilita la probabile presenza di biofilm, è opportuno decidere un’idonea strategia di trattamento tenendo conto del fatto che esistono vari stadi di formazione del biofilm stesso. Un approccio proattivo al trattamento riconosce che non esiste una soluzione costituita da un’unica fase per il trattamento del biofilm, ma che lo scopo è ridurre la carica batterica e prevenirne la ricostituzione” (World Union of Wound Healing Societies – WUWHS – Congresso di Firenze, Documento di posizionamento. Gestione del biofilm. Wounds International 2016)
La gestione delle lesioni mediante rimozione del biofilm batterico
Wolcott (2015) afferma che: “La gestione delle lesioni mediante rimozione del biofilm sifonda sull’utilizzo di più strategie di trattamento contemporaneamente che comprendano la somministrazione di antibiotici, agenti anti-biofilm, antimicrobici selettivi e frequente debridement.”
Inoltre, Hurlow et al (2015) avvertono che, sebbene le attività mirate contro il biofilm siano importantissime, occorre anche potenziare la risposta dell’ospite, considerando con molta attenzione tutte le cause locali e sottostanti della ritardata cicatrizzazione della lesione.
Infatti, se l’attività di prevenzione non ha successo i trattamenti a nostra disposizione sono:
- il regolare debridement della lesione cutanea
- l’utlizzo di antimicrobici/antibiofilm contenenti PHMB, (Poliesametilene Biguanide), da utilizzare per impacco
- gli ultrasuoni che riducono la carica batterica, stimolano la sintesi del collagene, l’angiogenesi e la fibrinolisi
- la terapia larvale, (non in Italia), per la capacità delle larve di destabilizzare il biofilm in combinazione con l’effetto antibatterico.
Trattamento per la gestione delle ferite croniche e del biofilm batterico
In conclusione, appare evidente come gestire in modo adeguato il biofilm batterico è un compito complesso. La fase fondamentale è quella preventiva con una sistematica valutazione della lesione (approccio TIME che si basa sui concetti di tessuto, infezione/infiammazione, umidità e bordi della lesione.) e un corretto assessment della persona portatrice di lesione.
In parallelo è importante il continuo aggiornamento degli operatori del settore, ricordiamo infatti che le già citate Linee Guida ESCMID 2015 che offrono un orientamento per la diagnosi e il trattamento del biofilm rimangono un ottimo strumento di formazione ma saranno necessarie ulteriori ricerche per comprendere meglio queste comunità di batteri.
Autori:
- Alessandro Landolfi (infermiere Case Manager esperto in Wound Care),
- Chiara Marnoni (responsabile Formazione Studio DMR)
www.studioinfermieristicodmr.it



















Scrivi un commento
Accedi per poter inserire un commento